原发性肝癌是我国最常见的恶性肿瘤和肿瘤致死病因之一,分别排在第四位和第二位,,主要包括肝细胞癌(HCC)、肝内胆管癌(ICC)和 HCC-ICC 混合型 3 种不同病理学类型,其中 HCC 占 85% ~ 90%,因此规范中的肝癌指 HCC。
规范肝癌的诊断和治疗对于提高肝癌患者的诊疗水平,改善患者生存质量非常重要。原卫生部和国家卫生计生委曾于2011年和2017年印发肝癌诊疗规范,在诊疗过程中发挥了重要作用。
结合肝癌诊疗理念的变化,以及新药品和新技术的发展,中华人民共和国国家卫生健康委员会对《原发性肝癌诊疗规范(2017版)》进行修订,形成了《原发性肝癌诊疗规范(2019年版)》供临床使用。本规范于2020年1月6日在卫健委官网公布。
本文选取了其中的重点进行分析和解读,希望可以帮助大家更好得了解。
肝癌的高危人群
高危人群重点筛查,有助于肝癌的早发现、早诊断和早治疗,对提高肝癌的生存率有很大帮助。建议高危人群至少每隔6个月进行1次检查。以下是肝癌的高危人群:
1. 感染乙型肝炎病毒(HBV)和(或)丙型肝炎病毒(HCV);
2. 过度饮酒;
3. 非酒精性脂肪性肝炎;
4. 长期食用被黄曲霉毒素污染的食物;
5. 各种其他原因引起的肝硬化;
6. 有肝癌家族史。
如果年龄>40岁且为男性患肝癌的风险更大。
肝癌筛查的方法:肝脏超声检查+血清甲胎蛋白(AFP)。
肝癌的影像学检查要点分析
1. 超声检查(US)
超声检查因操作简便、实时无创、移动便捷等特点,是临床上最常用的肝脏影像学检查方法。
常规灰阶超声可早期、敏感地检出肝内占位性病变,可鉴别其是囊性或实质性、良性或恶性,并观察肝内或腹腔内相关转移灶、肝内血管及胆管侵犯情况等。
彩色多普勒血流成像可观察病灶内血供,同时明确病灶性质及与肝内重要血管的毗邻关系。
超声造影检查可提示肝肿瘤的血流动力学变化,帮助鉴别诊断不同性质肝肿瘤,在评价肝癌的微血管灌注和引导介入治疗及介入治疗后即刻评估疗效方面具有优势。
超声联合影像导航技术为肝癌的精准定位和实时微创消融提供了有效的手段(证据等级3)。术中超声及术中超声造影检查能更敏感地显示肝内直径约为5 mm的肝癌,更好地协同手术治疗(证据等级3级)。超声弹性成像可检测肝实质和肝内占位性病灶的组织硬度,为明确肝癌手术的可行性提供更多的辅助信息(证据等级3级)。
多种超声技术的联合应用,可为肝癌精准的术前诊断、术中定位、术后评估起到重要作用。
2.X线计算机断层成像(CT)和磁共振成像(MRI)
动态增强CT和多模态MRI扫描是肝脏超声和血清AFP筛查异常者明确诊断的首选影像学检查方法。
目前肝脏动态增强CT除常见应用于肝癌的临床诊断及分期外,也应用于肝癌局部治疗的疗效评价,特别是对经动脉化疗栓塞(TACE)后碘油沉积观察有优势。同时,借助CT后处理技术可进行三维血管重建、肝脏体积和肝肿瘤体积测量、肺和骨等其他脏器转移评价,广泛应用于临床。
肝脏多模态MRI具有无辐射影响、组织分辨率高、可多方位多序列参数成像的优势,且具有形态结合功能(包括扩散加权成像等)综合成像技术能力,成为肝癌临床检出、诊断、分期和疗效评价的优选影像技术。多模态MRI检出和诊断直径≤50px肝癌的能力优于动态增强CT(证据等级1)。
使用肝细胞特异性对比剂钆塞酸二钠(Gd-EOB-DTPA)可提高直径≤25px肝癌的检出率以及对肝癌诊断与鉴别诊断的准确性(证据等级2)。多模态MRI在评价肝癌是否侵犯门静脉、肝静脉主干及其分支、以及腹腔或后腹膜淋巴结转移等方面较动态增强CT也更显优势。
3. 数字减影血管造影(DSA)
DSA是一种侵入性创伤性检查,多主张采用经选择性或超选择性肝动脉进行DSA检查。该技术更多用于肝癌局部治疗或急性肝癌破裂出血治疗等。
DSA检查可显示肝肿瘤血管及肝肿瘤染色,还可明确显示肝肿瘤数目、大小及其血供情况。
DSA检查能够为血管解剖变异、肝肿瘤与重要血管解剖关系、以及门静脉浸润提供准确客观的信息,对于判断手术切除的可能性、彻底性以及制定合理的治疗方案有重要价值。
4.正电子发射计算机断层成像(PET/CT)
PET/CT的优势在于,对肿瘤进行分期,通过一次检查能够全面评价有无淋巴结转移及远处器官的转移;再分期,因为PET/CT影像不受解剖结构的影响,可准确显示解剖结构发生变化后或者解剖结构复杂部位的复发转移灶;疗效评价,对于抑制肿瘤活性的靶向药物,疗效评价更加敏感准确。
5.穿刺活检
具有典型肝癌影像学特征的肝占位性病变,符合肝癌临床诊断标准的病人,通常不需要以诊断为目的的肝病灶穿刺活检(证据等级1)。对于能手术切除或准备肝移植的肝癌病人,不建议术前行肝病灶穿刺活检,以减少肝肿瘤播散风险。对于缺乏典型肝癌影像学特征的肝占位性病变,肝病灶穿刺活检可获得明确的病理诊断。肝病灶穿刺活检可对明确病灶性质、肝病病因、肝癌分子分型、为指导治疗和判断预后提供有价值的信息。
肝癌的血液学分子标志物
血清 AFP 是当前诊断肝癌和疗效监测常用且重要的指标。血清 AFP ≥ 400μg/L,排除妊娠、慢性或活动性肝病、生殖腺胚胎源性肿瘤以及消化道肿瘤后,高度提示肝癌。血清 AFP 轻度升高者,应作动态观察,并与肝功能变化对比分析,有助于诊断。 对血清 AFP 阴性人群,可借助血清甲胎蛋白异质体(AFP-L3)、异常凝血酶原(PIVKA II)和血浆游离微小核糖核酸(microRNA)行早期诊断。
肝癌的病理学诊断
肝占位性病灶或肝外转移灶活检或手术切除组织标本,经病理组织学和(或)细胞学检查诊断为肝癌。病理学检查申请单应提供病人的HBV/HCV感染史、肿瘤血清学分子标志物以及影像学检查等相关信息。
肝癌的病理学诊断规范由标本处理、标本取材、病理学检查和病理报告等部分组成。
肝癌的临床诊断标准及路线图
需要结合肝癌发生的高危因素、影像学特征以及血清学分子标志物,依据路线图的步骤对肝癌做出临床诊断。
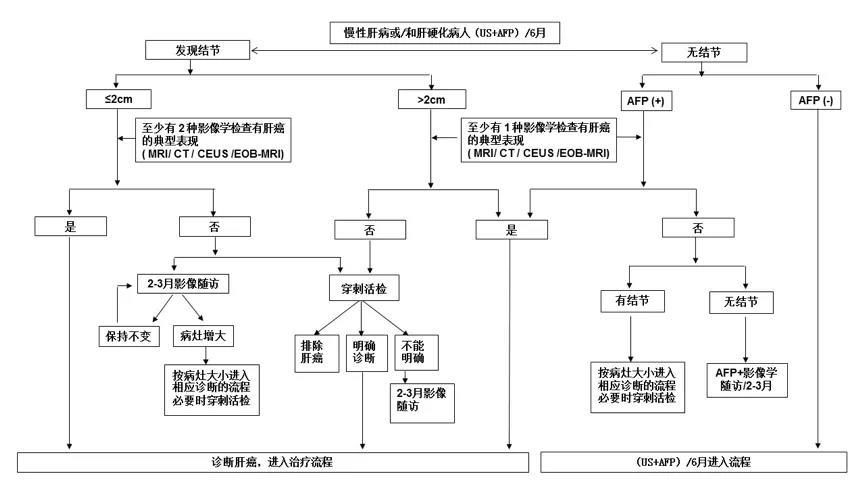
肝癌诊断路线图
典型表现:增强动脉期(主要动脉晚期)病灶明显强化,门静脉或平衡期强化下降,呈快进快出强化方式。不典型表现:缺乏动脉期病灶强化或门静脉和平衡期强化没有下降或下降不明显,甚至强化稍有增加等。
肝癌的分期
肝癌的分期对于预后评估、合理治疗方案的选择至关重要。结合中国的具体国情及实践积累建立中国肝癌的分期方案(CNLC),可分为:
CNLC Ia 期:体力活动状态(performance status,PS)评分 0 ~ 2 分,肝功能 Child-Pugh A/B 级,单个肿瘤、直径 ≤ 125px,无血管侵犯和肝外转移;
CNLC Ib 期:PS 0 ~ 2 分,肝功能 Child-Pugh A/B 级,单个肿瘤、直径 ﹥ 125px,或 2 ~ 3 个肿瘤、最大直径 ≤ 75px,无血管侵犯和肝外转移;
CNLC IIa 期:PS 0 ~ 2 分,肝功能 Child-Pugh A/B 级,2 ~ 3 个肿瘤、最大直径 ﹥ 75px,无血管侵犯和肝外转移;
CNLC IIb 期:PS 0 ~ 2 分,肝功能 Child-Pugh A/B 级,肿瘤数目 ≥ 4 个、肿瘤直径不论,无血管侵犯和肝外转移;
CNLC IIIa 期:PS 0 ~ 2 分,肝功能 Child-Pugh A/B 级,肿瘤情况不论、有血管侵犯而无肝外转移;
CNLC IIIb 期:PS 0 ~ 2 分,肝功能 Child-Pugh A/B 级,肿瘤情况不论、血管侵犯不论、有肝外转移;
CNLC IV 期:PS 3 ~ 4,或肝功能 Child-Pugh C 级,肿瘤情况不论、血管侵犯不论、肝外转移不论。
肝癌治疗领域的特点是多种治疗方法、多个学科共存,包括肝切除术、肝移植术、局部消融治疗、TACE、放射治疗、全身治疗等多种手段。

中国肝癌临床分期及治疗路线图
外科治疗要点解析
肝癌的外科治疗是肝癌病人获得长期生存最重要的手段,主要包括肝切除术和肝移植术。
肝切除术要点分析:
- 1.肝切除术的基本原则:彻底性:完整切除肿瘤,切缘无残留肿瘤;安全性:保留足够体积且有功能的肝组织(具有良好血供以及良好的血液和胆汁回流)以保证术后肝功能代偿,减少手术并发症、降低手术死亡率。
- 2. 一般认为肝功能 Child-Pugh A 级、ICG-R15 ﹤ 30% 是实施手术切除的必要条件;剩余肝脏体积须占标准肝脏体积的 40% 以上(肝硬化病人)、或 30% 以上(无肝硬化病人)也是实施手术切除的必要条件。术前评估方法,还包括肝脏硬度的测定、门静脉高压程度等。
- 3. 肝脏储备功能良好的 CNLC Ia 期、Ib 期和 IIa 期肝癌是手术切除的首选适应证。在部分 CNLC IIb 期和 IIIa 期肝癌病人中,手术切除有可能获得良好的效果。此外,术中局部消融、术前 TACE、术前适形放疗等方法可能提高 CNLC IIb 期和 IIIa 期肝癌的切除率。
- 4. 肝切除时经常采用入肝(肝动脉和门静脉)和出肝(肝静脉)血流控制技术;术前三维可视化技术有助于提高肝切除的准确性;腹腔镜技术有助于减少手术创伤,但其长期的疗效尚需随机对照研究验证。
- 5. 对于肝肿瘤巨大且剩余肝脏体积较小的病人,可采用术前 TACE 使肿瘤缩小,或门静脉栓塞/结扎和 ALPPS 使剩余肝脏代偿性增生的方法提高切除率。
- 6. 对于不可切除的肝癌,术前可使用 TACE、外放疗等获得降期后再行切除;但是对于可切除肝癌,术前 TACE 并不能提高疗效。
肝移植术要点分析:
1.肝移植是肝癌根治性治疗手段之一,尤其适用于肝功能失代偿、不适合手术切除及局部消融的早期肝癌病人。
2. 推荐UCSF标准作为中国肝癌肝移植适应证标准。
3. 肝癌肝移植术后早期撤除/无激素方案、减少肝移植后早期钙调磷酸酶抑制剂的用量、采用mTOR抑制剂的免疫抑制方案(如雷帕霉素、依维莫司)等可能有助于减少肿瘤复发,提高生存率。
4. 肝癌肝移植术后一旦肿瘤复发转移,病情进展迅速,在多学科诊疗基础上的综合治疗,可延长病人生存时间。
局部消融治疗要点解析
- 1.局部消融治疗适用于 CNLC Ia 期及部分 Ib 期肝癌;无血管、胆管和邻近器官侵犯以及远处转移,肝功能分级 Child-Pugh A 级或 B 级者,可获得根治性的治疗效果。对于不能手术切除的直径 3 ~ 175px 的单发肿瘤或多发肿瘤,可联合 TACE。不推荐消融根治性治疗的病人,给予术后索拉非尼辅助治疗。
- 2. 对于能够手术切除的早期肝癌病人,RFA 的无瘤生存率和总生存率类似或稍低于手术切除,但并发症发生率、住院时间低于手术切除。对于单个直径 ≤ 50px 肝癌,RFA 的疗效类似或优于手术切除,特别是位于中央型的肝癌。对于不能手术切除的早期肝癌病人,RFA 可获得根治性的疗效,应推荐其作为一线治疗。
- 3. PEI 适用于直径 ≤ 75px 肝癌的治疗,局部复发率高于 RFA,但 PEI 对直径 ≤ 50px 的肝癌消融效果确切,远期疗效类似于 RFA。4. 消融治疗后约 1 个月,复查动态增强 CT 或 MRI,或者超声造影,以评价消融效果。
TACE 治疗要点解析
- 1.TACE 是肝癌非手术治疗最常用的方法之一,应严格掌握 TACE 治疗的适应证和禁忌。2. TACE 治疗前应全面造影检查了解肝癌的动脉供血情况,包括肝动脉和异位侧支血管供血情况。采用微导管超选择性插管至肿瘤的供养动脉分支内进行化疗栓塞。
- 3. 合理的使用栓塞剂:常规 TACE 以带有化疗药物的碘化油乳剂为主,联合明胶海绵颗粒、空白微球和聚乙烯醇等颗粒型栓塞剂可进一步提高疗效。
- 4. 栓塞时需尽量使肿瘤去血管化,但需注意碘油乳剂的用量,可联合颗粒型栓塞剂提高疗效同时减少并发症发生。
肝癌放射治疗要点解析
- 1.CNLC Ia、部分 Ib 期肝癌病人,如无手术切除或局部消融治疗适应证或不愿接受有创治疗,也可考虑采用肝癌立体定向放疗作为替代治疗手段。
- 2. CNLC IIa、IIb、IIIa 期肝癌病人,TACE 联合外放疗,可改善局部控制率、延长生存,可适当采用。
- 3. CNLC IIIb 期肝癌病人部分寡转移灶者,可行 SBRT 放疗,延长生存;外放疗也可减轻淋巴结、肺、骨、脑或肾上腺转移所致疼痛、梗阻或出血等症状。
- 4. 部分肿瘤放疗后缩小或降期可获得手术切除机会;外放疗也可用于肝癌肝移植术前桥接治疗或窄切缘切除术后辅助治疗。
- 5. 肝肿瘤照射剂量:立体定向放疗一般推荐 ≥ 30 ~ 60Gy/3 ~ 6 次,常规分割放疗一般为 50 ~ 75Gy,照射剂量与病人生存密切相关。
- 6. 图像引导放疗优于三维适形放疗或调强放疗技术,立体定向放疗必须在图像引导放疗下进行。
系统治疗要点解析返回搜狐,查看更多
- 1.晚期肝癌病人的姑息一线治疗方案可选择索拉非尼、仑伐替尼或者含奥沙利铂的系统化疗。2. 姑息一线、二线系统治疗的适应证主要为:①合并有血管侵犯或肝外转移的 CNLC IIIa、IIIb 期肝癌病人;②虽为局部病变,但不适合手术切除和 TACE 的 CNLC IIb 期肝癌病人;③合并门静脉主干或下腔静脉瘤栓者;④多次 TACE 后肝血管阻塞和(或)TACE 治疗后进展的病人。二线姑息治疗方案可选择瑞戈非尼。
- 3. 在抗肿瘤治疗的同时,应积极控制基础肝病,包括抗病毒、保肝利胆治疗,还要酌情进行支持对症治疗等。(本文节选自「原发性肝癌诊疗规范(2019)」)
责任编辑: